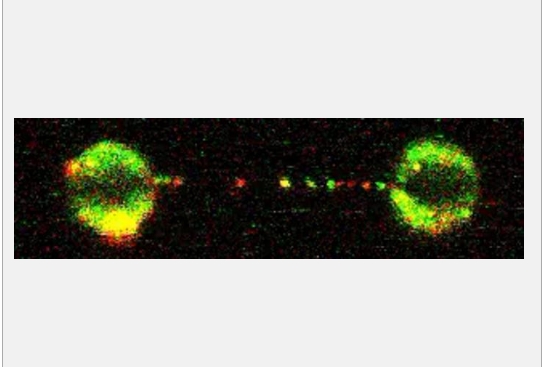
使用微型珠子(大圆圈)捕获单个DNA分子(无法直接看到)。珠子之间移动的每个红点、绿点或黄点代表 FANCD2-FANCI蛋白复合物沿着DNA分子滑动,监测其是否受损。图片来源:英国帝国理工学院医学实验室
科技日报记者 张佳欣
英国帝国理工学院医学实验室和分子生物学实验室的研究人员合作解开了一个数十年之久的谜团。他们揭示了如何识别DNA损伤并启动其修复的基本机制。这项研究使用尖端的成像技术来可视化DNA修复蛋白是如何在单个DNA分子上移动的,并使用电子显微镜来捕捉它们是如何“锁定”特定DNA结构的,为更有效地治疗癌症开辟了新的道路。相关论文发表于最新一期《自然》杂志。
此次研究的是一种DNA修复途径,其被称为范可尼贫血(FA)通路。实际上,DNA不断受到环境因素的损害,包括紫外线、饮酒、吸烟、污染等。交联是DNA受损害的一种方式,它会阻止DNA正常复制和表达基因。DNA损伤的积累可能会导致癌症。
为了自我复制以及读取和表达基因,DNA双螺旋结构的两条链先要解开成单链,形成Y形复制叉。当DNA发生交联时,两条链的“核苷”就会黏在一起,从而阻止这种解开。
研究团队此前已发现,由蛋白质FANCD2和FANCI组成蛋白质复合物D2-I在FA通路的第一步中会起作用。它夹住DNA,从而在交联时启动DNA修复。然而,问题的关键是,D2-I如何识别交联DNA,以及为什么D2-I复合物也与其他类型的DNA损伤有关?
团队使用显微镜技术识别了FANCD2蛋白的特定部分——KR螺旋。单分子成像实验表明,KR螺旋对于识别和停滞在单股DNA缺口至关重要。进一步研究表明,D2-I复合物利用KR螺旋在这些连接处停滞的能力对于FA通路的DNA修复至关重要。
研究表明,触发D2-I复合物停止滑动并夹住DNA以启动修复的是复制叉内的DNA结构,而不是DNA交联过程本身。这些停滞的复制叉出现在许多类型的DNA损伤中,这就解释了D2-I复合物在其他形式的DNA修复以及通过FA通路中发挥的广泛作用。
了解DNA修复的过程及其失败的原因具有非常重要的意义。许多抗癌药物都是通过对癌细胞造成严重损伤,使其停止分裂并死亡而起作用。在这种情况下,DNA修复途径可能会被癌细胞利用,以产生抗药性。了解DNA修复途径第一步的机制或有助找到提高癌细胞药物敏感性的方法。















