科技日报记者 张梦然
美国耶鲁大学合成生物学家创建了一种新型基因组重新编码生物体(GRO),并命名为“赭石”(Ochre),实现了对生物体遗传密码的重写。这一成果发表在最新一期《自然》杂志上,不仅促进了人类对遗传密码可塑性的理解,也为未来合成生物学的应用提供了更多可能。
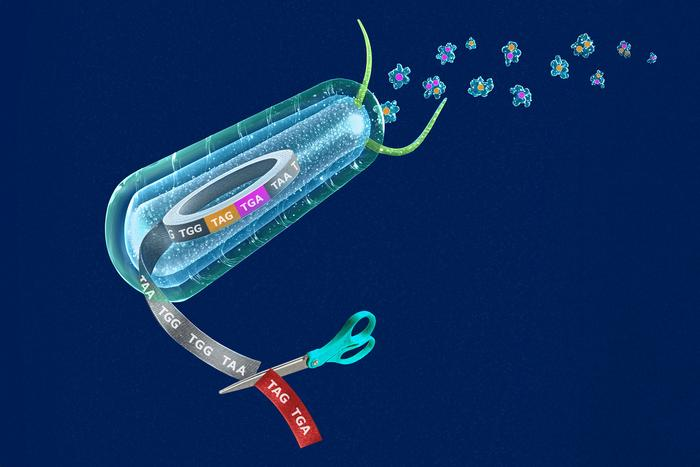
在这项研究中,科学家成功将DNA或RNA中的冗余密码子压缩成单一密码子。密码子用于指导特定氨基酸的加入或指示蛋白质合成的终止。具体来说,密码子是DNA和RNA中由3个核苷酸组成的序列,它在蛋白质合成过程中起到“说明书”的作用,指示细胞将20种天然氨基酸中的某一种添加到正在增长的蛋白质链中。此外,存在3种“终止密码子”:TAG、TGA和TAA,它们标志着蛋白质合成的结束。
此次,科学家消除了大肠杆菌中用于终止蛋白质合成的3个“终止密码子”中的两个,并重新分配了密码子的功能,使非标准氨基酸能够被编码进蛋白质中。
这项突破性工作,基于超过1000次精确编辑的全基因组工程,其规模比以往任何同类工程都要大一个数量级。此外,科学家还利用人工智能(AI)技术,设计并改良了必需的蛋白质和RNA翻译因子,创造了一种可以使用两种非标准氨基酸的新菌株。这些非标准氨基酸赋予蛋白质新的特性,如降低免疫原性或增强导电性,从而为可编程生物治疗药物和生物材料的发展开辟了新途径。
“赭石”的创建,是向构建具有非冗余遗传密码大肠杆菌迈出的重要一步,它特别适合生产含有多种不同合成氨基酸的蛋白质。同时,通过这种技术生产的合成蛋白质,对于医疗和工业应用均拥有巨大潜力。
总编辑圈点:
“赭石”的诞生,无疑标志着合成生物学进入了一个新时代。它显著推动了我们对遗传密码的理解。这种理解为探索新的生物学功能开辟了道路,例如设计特定功能的蛋白质、降低免疫原性研究等,都将极大促进个性化医疗的发展。此外,在工业上,该技术也有望带来更高效、环保的生物制造方法。不过,我们也要看到这一进步背后的伦理与技术挑战:如何确保其在医学上被安全使用?怎样平衡其益处与风险?这些或是未来需要深入探讨的问题。

















