科技日报记者 张佳星
近年来发展迅速的CAR-T(一种靶向免疫细胞)疗法已有多个针对血液肿瘤的产品上市,但还没有针对实体瘤的产品上市。
3月17日,一种全新的可进入实体肿瘤内部的减毒工程菌登上《自然·癌症》杂志。它不仅能有效杀伤实体瘤,而且可“遥控”。
“我们利用自然界中一些细菌可以在实体瘤内部的缺氧、免疫抑制微环境中定植的特性,经过合成生物学方法对其进行重编程改造。”3月17日,论文通讯作者、华东师范大学生命科学学院教授叶海峰告诉科技日报记者,改造获得的减毒工程菌,即“溶瘤细菌”,能够攻入免疫细胞也难进入的实体肿瘤内部,为肿瘤精准治疗提供创新性解决方案。
创造可“遥控”的溶瘤细菌
“由于实体肿瘤内部致密而缺氧,无论是传统药物还是免疫细胞都难以攻入。”叶海峰说,大肠杆菌、沙门氏菌、李斯特菌等细菌却比免疫细胞更加“皮实”,不仅能在恶劣的肿瘤微环境中活下来,还能表达一些刺激免疫系统的因子或有细胞毒性的蛋白。
因此,这些细菌被认为是开展肿瘤治疗的合成生物学有用“底盘”,但如果要向体内派入一支“队伍”,需要对其进行精准控制才更具临床价值。比如,CAR-T疗法用CAR作为精准制导元件,抗体药物通过抗原抗体原理实现“靶向”,就连传统药物也通过肠溶制剂等不同修饰,控制药物的“聚集地”。
如何“遥控”细菌?团队找到采用近红外光的方法。叶海峰说,他们曾对超声控制、热控制、蓝光控制等各种不同的控制元件进行了评估,但由于它们存在需要专用超声设备、可能对健康组织造成潜在热损伤、蓝光的组织渗透深度有限等缺点而放弃。
“近红外光波长为650至900纳米,它在组织中的吸收和散射效应优异,组织穿透性强。”叶海峰说,团队将近红外光响应的光遗传元件,即一段构建好的光控基因序列,嵌入细菌基因组。当特定波长的近红外光穿透皮肤照射肿瘤时,开关会立即启动细菌的“制药流水线”合成免疫激活剂、蛋白降解酶等,杀伤肿瘤细胞。

“我们还精准敲除了细菌内部15个与毒性相关的基因,在保留细菌肿瘤靶向能力和瘤内增殖活性的同时,显著降低了其毒副作用。”叶海峰说。
人源模型证明光控细菌安全有效
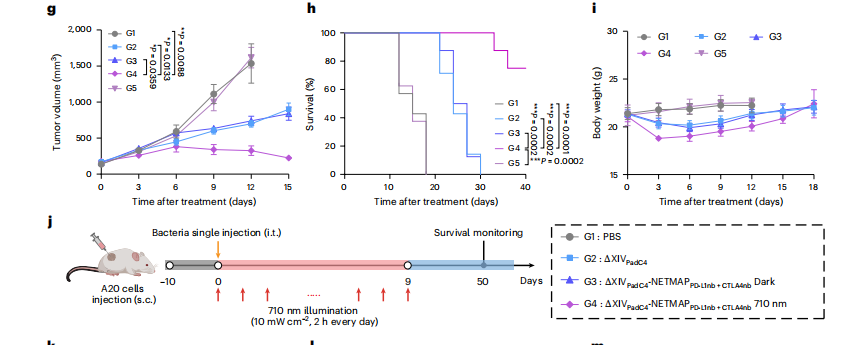
“我们将近红外光照射可启动的系统命名为‘NETMAP’。”叶海峰介绍,与黑暗相比,近红外光激活的NETMAP系统能让报告基因的表达多55倍。
正是基于这样强效的激活,细菌才能够在实体瘤内部产生足够多的杀伤肿瘤因子,如免疫检查点抑制剂、细胞毒性蛋白等,起到杀伤肿瘤细胞、抑制肿瘤生长的效果。肿瘤小鼠的试验证明了这一点。论文显示,注射了减毒工程菌的肿瘤小鼠在照射近红外光10天左右,肿瘤停止生长或逐步缩小,而其他对照小鼠则出现了肿瘤不断增加,直至死亡的现象。
叶海峰介绍,动物试验显示这种治疗方案对包括结直肠癌、乳腺癌等多种肿瘤模型均具有抑制效果。为更贴近临床实际,研究团队还构建了结直肠癌患者来源的移植肿瘤小鼠模型,进一步证实了该策略的临床转化价值。
“我们还针对肿瘤免疫原性的差异,开发了智能化的精准治疗策略。”叶海峰说,一些肿瘤是“伪装派”,通过抑制免疫细胞的“检查点”逃开免疫系统,团队为此设计了能精准释放免疫检查点抑制剂的细菌,让肿瘤被免疫系统重新识别;对付一些肿瘤的“强硬派”,细菌就被设计成释放细胞毒性蛋白,可直接杀伤肿瘤细胞。
“合成生物学较好地利用自然界‘相生相克’原理,通过精巧的设计,为肿瘤治疗提供了全新的思路和可行的临床路径。”叶海峰说。
(图片由科研团队提供)